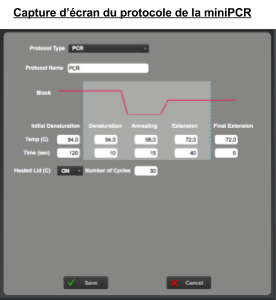
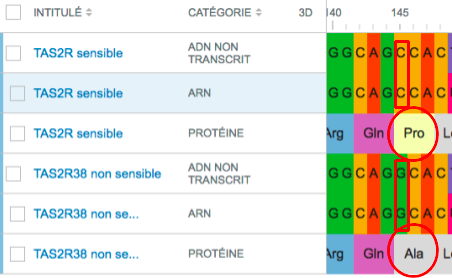
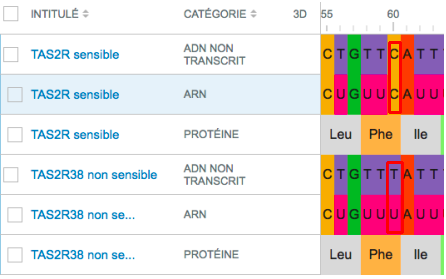
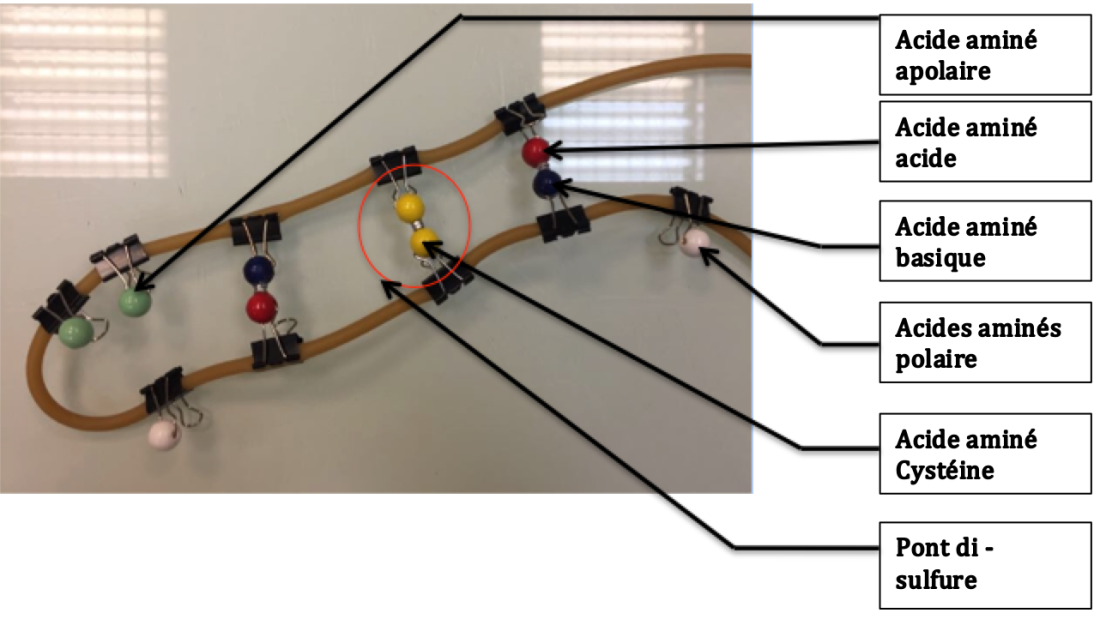
Nous nous sommes rendus compte que dans notre projet, il manquait une explication de POURQUOI certaines personnes avaient un gène muté qui les rendait sensible au PTC. Ici nous étudions un facteur extérieur qui peut entraîner des mutations, les rayonnements radioactifs.
I. Effets biologiques
On distingue deux types d’effets biologiques dues au rayonnement radioactif sur l’organisme:
- Les effets déterministes
Ces effets sont liés au dépassement d’un certain seuil d’absorption des rayonnements, et sont généralement prévisibles, et sont proportionnels à la dose.
Au niveau moléculaire, les rayonnements entraînent des ruptures de la molécule d’ADN au sein du noyau cellulaire (cf. schéma ci-contre) .

La cellule possède des mécanismes de réparation, mais lorsque ces mécanismes ne sont pas suffisants face à la force du rayonnement, la cellule peut mourir. Cette mort massive des cellules ne peut pas être compensée par le renouvellement des cellules. Au niveau macroscopique, cela se traduit par des effets sur la peau, car c’est le premier tissu à subir les rayonnements. Suivant l’exposition (du moins au plus important), on a une dépilation (1-3 Joules/kg), des oedèmes (12-15 J/kg), une nécrose (25-30 J/kg), pour une exposition localisée.
Pour une exposition généralisée (tout le corps), “la dose létale 50” (étant la dose tuant 50 % des sujets exposés au rayonnement au bout de 60 jours si aucun traitement n’est administré), est fixée à 5 J/kg (ou 5 gray). Au delà de 10 grays, la mort est pratiquement certaine.
Lors d’une exposition des testicules à plus de 3,5 gray, la stérilité permanente s’ensuit. Dans le cas des ovaires une exposition à 2,5 gray ou plus suffit à provoquer la stérilité permanente.
- Les effets stochastiques (ou aléatoires)
Ces effets se distinguent des effets déterministes par le fait qu’ils sont aléatoires. En effet la sévérité de ces effets est indépendante de la dose, et leur prédiction avec certitude est impossible. Les effets stochastiques sont le résultat de la survie, puis de la réplication de cellules mutées, qui sont passées à travers les mécanismes de réparation cellulaire. Ainsi, de nombreux effets stochastiques sont le résultat d’une faible dose d’irradiation. Lorsqu’une cellule mutée se multiplie, et que les mécanismes de mort programmée de la cellule sont inhibés (apoptose) on assiste à l’apparition de cancers. C’est ainsi que des cancers du poumon, de la thyroïde, peuvent se déclarer jusqu’à quarante ans après la contamination. On estime que le risque de cancer augmente de 1% tous les 100 milli – sievert.
Les effets stochastiques peuvent aussi affecter la progéniture des personnes contaminées. L’exposition d’un oeuf fécondé avant le neuvième jour aux rayonnements peut entraîner la mort de l’oeuf, à cause de sa sensibilité très grande aux radiations. Un embryon peut aussi subir les effets d’une exposition aux rayonnements: pendant l’organogénèse (4e à 8e semaine de grossesse). Le foetus est également vulnérable pendant la formation du système nerveux (8e à 16e semaine). Une exposition peut entraîner malformations et retards mentaux.
Enfin, il existe un risque faible mais réel d’atteinte à l’enfant via la mutation d’un gamète chez les parents. Ceci entraîne des mutations chez l’enfant. Cependant, ce risque demeure faible pour la raison suivante: une cellule germinale mutée a peu de chances d’être fécondée. Cette contamination peut cependant mener à la mort de l’embryon.
II. Applications de la radioactivité

Les rayonnements peuvent être utilisés :
→ comme outils de suivi : des marqueurs (atomes radioactifs) étant introduits dans un milieu, il est ensuite aisé de détecter les rayonnements qu’ils émettent et de suivre leur devenir (applications en médecine, sciences, chaîne alimentaire, environnement …),
→ en imagerie : l’atténuation d’un faisceau lors de sa traversée de la matière dépend des matériaux traversés et de leurs épaisseurs (investigations en médecine,sciences, industrie…),
→ en traitement : l’énergie déposée par les rayonnements dans la matière vivante peut être importante et détruire les organismes (traitement des tumeurs, destruction des bactéries, stérilisation….).
Dans la Médecine:
Les rayonnements radioactifs sont très utiles dans le monde de la médecine. En effet, ils sont utilisés pour l’imagerie médicale ainsi que pour les traitements des cancers et pour la stérilisation.
Concernant l’imagerie médicale, les photons sont utilisés pour les rayons X grâce à l’utilisation de photons. Les rayons X sont utilisés dans les hôpitaux pour la radiographie ou les scanners ainsi que dans les aéroports pour scanner les bagages. Donc les rayons X servent à traverser la matière, les photons qui sont les parties composantes de la lumière se réfléchissent sur les objets se trouvant dans un sac à l’aéroport ou bien sur les os ou parties du corps humain ou encore pour avoir des coupes de corps humain. Il y a aussi des traceurs qui sont insérés directement dans le corps comme par exemple dans le système digestif et qui sont observés par les médecins pour vérifier le bon fonctionnement du système digestif car les traceurs ont un rayonnement qui permet de détecter leur répartition. Ces traceurs sont le plus généralement des glucoses comme le FluoroDesoxyGlucose marqué au fluor 18 (FDG).
Les rayonnements radioactifs sont aussi utilisés pour la lutte contre le cancer. Les rayons sont utilisés afin de détruire les cellules malades qui ne sont plus capable de s’auto régénérer. La chimiothérapie est une thérapie sur longue durée qui comporte de nombreuses séances à des périodes espacées et qui consiste à irradier les cellules cancéreuses qui vont finir par être détruites. Les cellules saines seront également affectées mais parviendront à se régénérer grâce à la faible dose de radioactivité auxquelles elles auront étés exposées. C’est aussi le fonctionnement de la radiothérapie comme nous pouvons voir sur le schéma ci dessous:

Pour la radiothérapie, les rayons sont administrés tous les jours a petite dose, ainsi les cellules saines peuvent se régénérer d’un jour à l’autre alors que les cellules cancéreuses en seront incapables.
Enfin, les rayons radioactifs sont aussi utilisés pour désinfecter et stériliser des matériaux sans avoir à les chauffer. C’est donc une manière très utilisée notamment pour les instruments chirurgicaux qui sont traités directements dans leurs emballages afin d’avoir une stérilisation la plus totale. L’irradiation permet d’éliminer les moisissures, les insectes, les larves et les bactéries.
Dans la conservation:
La radioactivité est également utilisée pour dater des objets anciens, des squelettes ou des fossiles.
Le gaz carbonique présent dans l’atmosphère contient du carbone 12 stable et une très faible proportion de carbone 14 radioactif, formé continuellement par le rayonnement cosmique. Le gaz carbonique est échangé en permanence entre l’atmosphère et le monde vivant. Dès qu’un organisme meurt, le carbone 14 n’est plus renouvelé. Comme cet isotope se désintègre, sa proportion par rapport au carbone 12 se met alors à baisser. Moins il reste de carbone 14 dans l’échantillon à dater et plus il est ancien. Le carbone 14 est particulièrement utilisé pour déterminer l’âge d’objets de moins de 40 000 ans.
Après 5000 ans le rapport entre le carbone 14 et le carbone 12 n’est plus que la moitié de ce qu’il est dans l’atmosphère. Après 10000 ans, il n’est plus que ¼.

Dans l’Agriculture:
Les techniques de radiation sont souvent utilisées dans le domaine de l’agriculture. Par exemple, plusieurs installations d’accélérations d’électrons ont été mise en place en France afin d’irradier les fruits et légumes. L’ionisation des aliments a pour but de les conserver plus longtemps, et permet de détruire des parasites présents dans les stockages d’aliments.
 La photo ci dessus permet une comparaison de l’état d’oignons non irradiés et irradiés à une dose de40 à 60 grays.
La photo ci dessus permet une comparaison de l’état d’oignons non irradiés et irradiés à une dose de40 à 60 grays.
Source : https://www.csnsm.in2p3.fr/IMG/pdf/radioactivite-2007-applications-web.pdf
Dans le secteur du nucléaire:
- La Fission Nucléaire
La fission nucléaire est une autre forme de radioactivité, et consiste en la division de noyaux très lourds en 2 morceaux, laissant échapper des neutrons. Cette rupture produit des rayonnements alpha, beta et gamma. Ainsi s’ensuit une réaction en chaine, les neutrons échappés vont eux aussi être brisés en deux, et ainsi de suite. Cette réaction en chaîne produit une extrême quantité d’énergie et peut devenir explosive, c’est le cas des armes nucléaires. Mais cette fission est rarement spontanée. Afin de la déclencher, il suffit d’un petit apport d’énergie, par choc avec un neutron (par exemple).

Ce système de production d’énergie est le même que celui présent dans un combustible nucléaire.
A chaque fission, une énergie cinétique est produite. Une fois qu’elle entre en contact par la matière environnante, elle est freinée et se transforme en chaleur. Les pastilles servent à contrôler la réaction en chaîne. En conséquence : la pastille chauffe et conduit la chaleur vers le haut, vers la gaine, puis vers de l’eau pressurisée qui va bouillir. cela entraîne la création de vapeurs d’eau. De l’électricité est produite par l’usage de turbines et d’un alternateur.
 Flux neutronique dans le coeur d’un réacteur
Flux neutronique dans le coeur d’un réacteur
La première utilisation de la fission nucléaire a été pour les armes nucléaires envoyées sur Hiroshima et Nagasaki au Japon en 1945.
Sources :
https://www.csnsm.in2p3.fr/IMG/pdf/radioactivite-2007-applications-web.pdf
http://www.cea.fr/comprendre/Pages/energie-nucleaire.aspx
- La Fusion Nucléaire
Le processus de fusion consiste en la fusion de deux noyaux pour n’en former qu’un seul en libérant de l’énergie. Ce processus se déroule au coeur des étoiles, dégageant de grandes quantités d’energie, Contrairement à la fission qui concerne des noyaux lourds, la fusion necessite des noyaux legers. La matière nécessaire à la fusion, est illimitée sur terre. Afin de pouvoir mettre en oeuvre ce système de production d’énergie, il faut être capable de recréer l’environnement physique du coeur d’une étoile, afin de contrôler cette énergie. Autrement dit, il faut être capable d’atteindre les 150 millions de degrés celsius. Dans ces conditions, la matière se présente sous forme de plasma.
A la fin des années 1960, des scientifiques Russes sont parvenus à développer un système de confinement de plasma, par l’utilisation de champs magnétiques intenses. Cette machine s’appelle le “tokamak”.
Ce projet est une alternative aux énergies fossiles carbonées, qui sont les sources principales de pollution.
Sources :
http://www.cea.fr/multimedia/Documents/infographies/tokamak-defisCEA.pdf
https://www.csnsm.in2p3.fr/IMG/pdf/radioactivite-2007-applications-web.pdf
III. Précautions à prendre lors de la manipulation ou lorsqu’on cherche à s’en protéger
Nous sommes en permanence exposés aux rayonnements radioactifs. Cette exposition peut être interne si elle est situé à l’intérieur du corps, ou externe si elle est à l’extérieur. Généralement on peut se protéger des rayons radioactifs en :
- augmentant la distance entre nous et la source
 La distance est inversement proportionnelle à la puissance des rayonnements et réduit considérablement notre exposition.
La distance est inversement proportionnelle à la puissance des rayonnements et réduit considérablement notre exposition.
- diminuant la durée d’exposition
Moins on est exposé aux rayonnements, plus notre dose de rayonnement reçue est faible.
- utilisant des écrans protecteurs


Selon le type de rayonnement, le pouvoir de pénétration varie, il faut donc de différents types de matériaux d’épaisseurs différentes pour s’en protéger. En interposant un ou plusieurs écrans qui empêchent les rayonnements de les traverser entre la source de radioactivité et les personnes, on peut retirer l’exposition de ces personnes.
Une manipulation sans précautions peut engendrer une irradiation externe et même une contamination si la substance radioactive s’est dispersée.
Plus généralement, le principe ALARA “As low as reasonably achievable” lors de la manipulation de matériaux radioactifs. Celui ci vise à ce que l’exposition aux radiations soient au plus faible qu’elle puisse l’être.
On peut aussi porter un dosimètre lors de ces expériences, pour contrôler le niveau de radiations auxquelles on s’expose.
** les deux derniers schémas en noir et blanc proviennent du site : https://www.ssp.ulaval.ca/wp-content/uploads/2015/07/Formation-radioprotection_utilisateurs-de-matieres-radioactives_2015-05.pdf